Kalıtsal Bilginin Biyokimyasal Dili
Nükleik asitler canlılarda
kalıtsal bilginin oluşturulması, depolanması, kodlanması ve değiştirilmesinden
sorumlu olan polimerlerdir ve nükleotidlerin bir araya gelmesiyle oluşurlar.
Tek zincir bir nükleik asitte
nükleotidler birbirine fosfat ve şeker grupları üzerinden kovalent olarak bağlı
bulunur. Çok zincirli bir nükleik asitte zincirleri bir arada tutansa
nükleotidlerin azotlu organik bazları – ya da kısaca nükleobazları - arasındaki hidrojen bağlarıdır.
Doğada onlarca nükleobaz varken,
nükleik asitlerin birbirleriyle konuşmak için kullandığı dilin alfabesi
bunların sadece 5’ini harf olarak içerir: adenin (A), timin (T), guanin (G),
sitozin (C) ve urasil (U). Burada konuşmadan kastedilen nükleobazlar arasında
kurulan hidrojen bağları ile nükleik asitlerin birbiriyle etkileşmesi ve bu
etkileşimler aracılığıyla kalıtsal bilginin bir molekülden diğerine
aktarılması.
Canlılar
tarafından kalıtsal bilgiyi depolamak için kullanılan nükleik asitler
deoksiribonükleik asit ve ribonükleik asittir, yani meşhur kısaltmalarıyla DNA
ve RNA. DNA’da U, RNA’da ise T nükleobazı bulunmaz. Yani diğer nükleik
asitlerle konuşurken bir DNA molekülü U harfini telaffuz edemez, bir RNA
molekülü ise T harfini. Ve kalıtsal bilgi DNA’dan okunup RNA’ya ya da RNA’dan
okunup DNA’ya yazılırken T ile U yer değiştirir. Böylece nükleik asitlerin
alfabesi etkin olarak 4 harfe indirgenmiş olur.
DNA ya da RNA’da nükleobaz
dizileri formunda taşınan toplam kalıtsal bilginin başka biyopolimerlerin
sentezini kodlayan parçaları gen olarak adlandırılır. Bu polimerlerin başında
taşıyıcı RNA (tRNA) ve ribozamal RNA (rRNA) gibi özel işlevleri olan bazı RNA
çeşitleri ile amino asitlerin bir araya gelmesinden oluşan proteinler gelir.
Bir hücrenin yaşamını devam ettirmek için ihtiyacı olan diğer tüm biyomoleküllerin
sentezi de özünde birer protein olan, yani (birazdan kabaca özetleneceği
şekilde) genlerdeki depolanan kalıtsal bilgiye göre sentezlenen enzimler
tarafından katalize edilir.
Kalıtsal Bilginin Moleküler Akışı
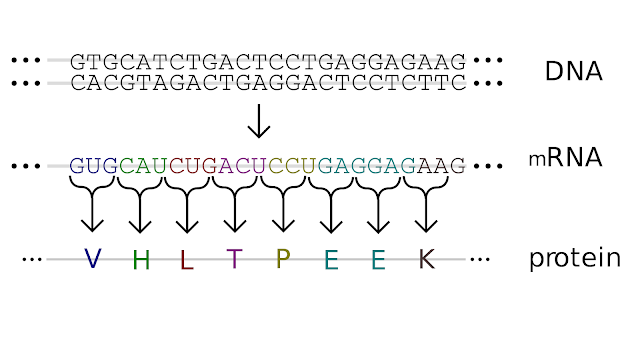
DNA’nın çift zinciri (genellikle)
Watson-Crick baz çiftleşmesi bağlamında birbirinin eşleniğidir, yani DNA’nın
iki zincirinde A ile T, G ile de C karşı karşıya gelir [1]. Protein sentezinin
ilk aşamasında (bazı enzimler aracılığıyla) öncelikle ilgili gen ve çevresinde
bu nükleobazlar arasındaki hidrojen bağlarının kırılması ve zincirlerin
birbirinden ayrılması gerekir. Bunun ardından (başka enzimler tarafından)
zincirlerden biri kalıp olarak seçilir ve bu kalıptan yine Watson-Crick baz
çiftleşmesi kullanılarak bir mesajcı RNA (mRNA) molekülü sentezlenir. Böylece
kalıp zincirin eşleniğindeki kalıtsal bilgi Resim 1’in üst yarısında
örneklendiği gibi mRNA’ya kopyalanmış olur.
İkinci aşamada mRNA molekülü
ribozom organeli aracılığıyla tRNA moleküllerinin antikodon kolları ile
etkileşir. Bir tRNA molekülünün antikodon kolundaki üç nükleobaz mRNA
molekülünde kendilerine karşılık gelen üç nükleobaz ile sırasıyla birer
Watson-Crick çifti oluşturuyorsa, tRNA’nın önceden yüklenmiş olduğu amino asit
protein sentezinde kullanılmak üzere taşıyıcısından ayrılır. Bu şekilde
tRNA’lar (kendilerine kodon adı verilen) mRNA’daki her üç nükleobaz için
ribozoma bir amino asit taşır. Uç uca eklenen amino asitlerden de protein
meydana gelir (bkz: Resim 1’in alt yarısı).
Amino asidini ribozomda bırakan
bütün tRNA’ların antikodon nükleobazları sırasıyla yan yana dizildiğinde kalıp
DNA zincirindeki nükleobaz dizisinin aynısı elde edilmiş olur. Bu bağlamda,
DNA’daki ardışık nükleobaz üçlülerine kod adı verilir. Her bir tRNA molekülü
sadece tek bir çeşit amino asit ile yüklenebildiği için, DNA’daki kod dizilimi,
bir anlamda, ribozomda sentezlenen proteindeki amino asit dizilimini belirlemiş
olur. Ya da diğer bir ifadeyle, kalıtsal bilgi DNA’dan mRNA ve tRNA molekülleri
aracılığıyla proteine akmış olur. Kalıtsal bilginin hücre içindeki bu tek yönlü
akışı moleküler biyolojinin merkezi dogması olarak da bilinir.
Resim 1 – Kalıtsal
bilginin hücre içinde akışı [2] : Son satırdaki renkli V, H, L, T, P, E ve K
harfleri sırasıyla valin, histidin, lösin, treonin, prolin, glutamat ve lizin
amino asitlerinin kısaltmasıdır.
Genetik Kodun Yozluğu
DNA’daki kod adı verilen ardışık
nükleobaz üçlülerinin sırası sentezlenen proteinin yapısındaki amino asit
dizisini belirlediği için, protein sentezinden sorumlu olan genlerin dört
harfli dilinde bütün kelimelerin 3 harf uzunluğunda olduğu söylenebilir.
Üç harf uzunluğunda olan ve 4
olası harften oluşan toplam 4 x 4 x 4 = 64 tane kelime vardır. Standart genetik
kodda bunlardan 3 tanesi protein sentezini durdurmak için kullanır. Kalan 61
kodun her biri ile antikodon kolunda eş nükleobaz dizilimine sahip bir tRNA
olması gerekir. Fakat canlıların çoğunda 45’ten az tRNA bulunur. Peki, neden?
tRNA’ların antikodon kollarının
3-boyutlu eğriliği yüzünden kodon – antikodon eşleşmesinde yozluk vardır: antikodonun
ilk nükleobazı bazen karşısındaki mRNA nükleobazının Watson-Crick çifti olmasa
da tRNA yüklendiği amino asidi protein sentezi için ribozomda bırakabilir [3].
Yani, 3 harf uzunluğundaki genetik kelimelerin ilk harflerindeki değişiklikler
bazen kelimelerin (amino asit) anlamlarını değiştirmeyebilir. Bu da kelimelerin
başlangıcında kullanılan birbirinden ayırt edilebilir harf sayısının aslında
4’ten küçük olması demektir.
Mesela, ilk harf için 3 ayırt
edilebilir seçenek mümkünse farklı anlama gelen kelime sayısı 3 x 4 x 4 = 48, 2
ayırt edilebilir seçenek mümkünse farklı anlama gelen kelime sayısı 2 x 4 x 4 =
33 olur. Bu da genelde 45’ten az olan tRNA sayısını açıklamaya yeter.
Daha önce her bir tRNA’nın sadece
tek bir amino asit ile yüklenebileceğinden bahsedilmişti. Doğada 700’den fazla
amino asit olduğu düşünülürse, proteinlerde kullanılan amino asit sayısının
eldeki tRNA sayısı ile kısıtlanıp 45 civarına inmesi beklenebilir. Fakat
proteinlerde sadece 20 farklı amino asit bulunur! Yani birden fazla tRNA aynı
amino asit ile yüklenebilir.
Üçlü Genetik Kodun Evrimi
Peki, erişilebilir amino asit sayısındaki
bolluğa rağmen tRNA – amino asit eşleşmesindeki bu yozluğun sebebi ne olabilir?
Bu soruya makul bir cevap
arayabilmek için genetik kodun evrimini anlamaya çalışmak gerekiyor. Öncelikle,
genetik işlerge öyle bir şekilde evrilmiş olmalı ki kalıtsal bilginin nükleik
asitlerden proteinlere akışı sırasında (varolan çevresel gürültüler sebebiyle)
gerçekleşen hatalara tolerans gösterebilsin. Mesela, kalıtsal bilgi aktarımı
sırasında tek bir nükleobazda yapılan hataların organizma için ölümcül
sonuçları olmamalı. Hatta üçlü bir kodun tek bir nükleobazında yapılan
değişiklik o koda karşılık gelen orjinal amino aside mümkün olduğunca benzer
kimyasal özelliklerde bir amino asidi kodlamalı. Diğer taraftan, mümkün
olduğunca az kaynak harcamak ve mümkün olduğunca çok amino asit kodlamak da
genetik işlergenin evriminde sürücü birer rol oynamış olmalı.
Bu şartlar altında en optimum
genetik kodun ne olduğu biraz istatistiksel fizik, biraz topolojik matematik ve
biraz da klasik enformasyon teorisi kullanılarak bulunabilir: azami 48 tRNA ve
asgari hata ile ayırt edilebilecek azami amino asit sayısı 20’dir [4].
Peki, kodon – antikodon
eşleşmesinde yozluk olmasaydı ne olurdu?
Bu durumda tRNA sayısı 64’e,
asgari hata ile ayırt edilebilecek azami amino asit sayısı ise 25’e çıkardı
[4]. Genetik kodun neden bu şekilde evrilmediği ve 20 amino asitte donduğu ise
cevap aranması gereken bir diğer güzel soru. Fakat bunun için moleküler evrimde
üçlü genetik kodun da öncesine gitmek gerekebilir.
DNA Öncesi Dünya ve İkili Genetik Kod
tRNA moleküllerinin bir amino
asit ile yüklenmesi aminoasil-tRNA sentataz (aaRS) enzimleri sayesinde
gerçekleşir. Kendileri de protein sentezinin sonucunda oluşan bu enzimler
nükleik asitlerle amino asitler arasındaki eşleşmeyi sağladıkları için aslında
protein sentezinin en hayati bileşenidir. Üstelik ilk ortaya çıkışlarının
yaşamın üç krallığa ayrılmasından çok daha önceye, hatta DNA öncesi dünyaya
gittiği kabul edilmektedir.
aaRS enzimleri her biri 20 amino
asidin bir yarısına özgül olan enzimleri içerecek şekilde 2 büyük sınıfa
ayrılır. Bu sınıflar arasında herhangi bir yapısal ya da işlevsel benzerlik
bulunmaz. Mesela, tRNA moleküllerine bağlanma stratejileri farklıdır. Diğer
taraftan, her bir sınıf içinde tüm üyelerce paylaşılan evrimsel olarak korunmuş
ortak motifler vardır ki bunlar enzim etkinliğinde önemli roller oynar. Bu
yüzden, 2 sınıfın zaman içinde birbirinden bağımsız olarak evrildiği
düşünülmektedir.
aaRS enzimlerinin bu ilginç
evrimsel geçmişi her biri 10 amino asit kodlayan birbirinden bağımsız 2 genetik
kodun DNA öncesi dünyada ayrı ayrı evrilip, daha sonra bir araya gelmiş
olabileceği olasılığını akla getirmektedir. Bu arkaik genetik kodlara en makul
aday da tRNA moleküllerinin alıcı kolları üzerinde bulunan ve aaRS enzimlerince
tanınan birkaç nükleobazlık bağlanma bölgeleridir [5].
Alıcı kola zıt doğrultuda
konumlanan antikodon kolundaki 3 nükleobaz genetik kodun evrimi sırasında bu
bölgelerden kopyalanıp, mevcut yerlerine göçmüş olabilir. Hatta kodon –
antikodon eşleşmesinde şu anda yozluk yaratan ilk nükleobaz 2 kodun birleşme
sürecinin başlarında sadece ikili bir sınıf ayıracı olarak işlev görmüş
olabilir.
Böyle bir evrimsel senaryo hem
kodon – antikodon eşleşmesindeki mevcut yozluğun kaynağını, hem de modern üçlü
genetik kodun neden 20 amino asitte donmuş olabileceğini açıklayabildiği için
üzerine daha fazla bilimsel araştırma yapılmasını hak ediyor. Üstelik bu
senaryoda arkaik genetik kodlar üçlü değil ikili olmalı. Ve teorik olarak
biliyoruz ki ikili bir optimum kodda azami tRNA sayısı 4 x 4 =16, asgari hata
ile ayırt edilebilecek azami amino asit sayısı ise 11’dir [4].
Kaynaklar
1) Watson, J.D. and Crick, F.H.C.
(1953). Molecular structure of nucleic acids: a structure for deoxyribose
nucleic acid, Nature, 171 (4356), 737–739. ; Genetical implications of the
structure of deoxyribonucleic acid, Nature, 171 (4361), 964–967.
3) Crick, F.H.C. (1966). Codon—anticodon pairing: The wobble
hypothesis. Journal of Molecular Biology. 19 (2): 548–555.
4) Tlusty, T. (2008). Rate-Distortion Scenario for the Emergence
and Evolution of Noisy Molecular Codes. Physical Review Letters. 100 (4):
048101. ; Tlusty, T. (2010). Acolorful origin for the genetic code: Information
theory, statistical mechanics and the emergence of molecular codes. Physics of
Life Reviews. 7: 362–376.
5) Schimmel, P., Giege, R., Moras, D., and Yokoyama, S. (1993). An
operational RNA code for amino acids and possible relationship to genetic code.
Proc. Natl. Acad. Sci. USA 90: 8763–8768. ; Ribas de Pouplana, L. and Schimmel,
P. (2001). Operational RNA Code for Amino Acids in Relation to Genetic Code in
Evolution. J. Biol. Chem. 276: 6881–6884. ; Shaul, S., Berel, D., Benjamini,
Y., and Graur, D. (2010). Revisiting the operational RNA code for amino acids:
Ensemble attributes and their implications. RNA 16: 141–153.
Yazının epiSTEM Türkiye bağlantısı:
https://epistemturkiye.org/genetik-kod-ve-molekuler-evrimi/